课程背景
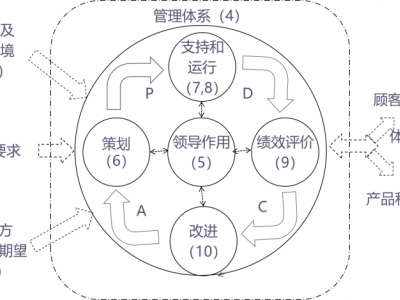
ISO 13485《医疗器械质量管理体系-用于法规的要求》是国际医疗器械行业的质量管理体系标准。自2010年启动升版以来,经过6年的准备和征求意见,新标准已经于2016年3月1日正式发布。新标准融入了医疗行业,全球专家和主管当局的反馈意见,增加了大量医疗器械行业*实践,兼容了包括*FDA、日本JPAL、巴 西ANVISA GMP 等国家医疗器械法规的要求,是一部将质量管理体系和法规注册及监管更加紧密结合的标准。新标针对设计和研发等要求可以帮助提升器械自主研发能力,并保证医疗器械的安全有效,从而提升医疗器械企业的自身竞争力。本课程专为医疗器械行业人员而设,学员将全面理解 ISO 13485:2016质量管理体系的要求、特殊过程确认要求、批记录的管理、医疗器械生产质量管理规范部分要求及医疗器械注册和生产许可的相关要求。
通过小组活动、审核演练、互动讨论和教练式课程等方式深入理解审核原则和如何应用 ISO 13485标准来执行有效的内审。
课程收益
认识质量管理的基本原则;
学习ISO 13485质量管理体系标准;
了解医疗器械风险管理思路;
了解审核技巧和方法及审核流程控制;
了解有效开展审核应注意的问题。
课程对象
从事医疗器械及相关行业的企业经营领导者、内部审核员、文控人员、质量管理人员、产品设计开发人员、生产技术 人员、市场营销人员或有志从事 ISO13485 工作的人士等;
凡生产二类,三类产品的医疗器械生产企业必须有2-4名内审员,未配有内审员的企业应派人员参加培训,参加质量体系考核的人员都必须取得内审员资格;
课程大纲
第一天
一、ISO13485:标准的发展
二、ISO13485:2016标准条款解释 (包含医疗器械生产质量管理规范部分内容)
三、ISO13485:2016标准第一章范围
四、ISO13485:2016标准第二章规范性引用文件
五、ISO13485:2016标准第三章术语和定义
六、ISO13485:2016标准第四章质量管理体系
七、ISO13485:2016标准第五章管理职责
八、ISO13485:2016标准第六章资源管理
九、ISO13485:2016标准第七章产品实现
第二天
一、ISO13485:2016标准第八章测量分析和改进
二、特殊过程确认要求
三、批记录管理
四、医疗器械注册和生产许可的相关要求
五、内部审核的策划和实施
六、案例分析和考试
医疗器械质量管理体系

 (微信同号)
(微信同号)